|
|
|
OBIETTIVO Verificare la seconda legge di Charles e Gay-Lussac: a
volume costante, la pressione di un gas è direttamente proporzionale alla sua temperatura
assoluta.
STRUMENTI
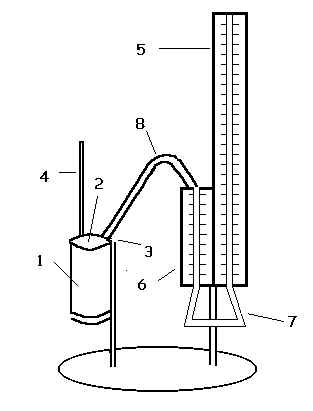
La spiegazione degli strumenti utilizzati è uguale a quella fornita nella prima legge
di Gay Lussac.
PROCEDURA
- Collegare il recipiente di alluminio, contenente circa 1l d’acqua, con il tubo di
gomma.
- Immergere una camera cilindrica nel recipiente, inserire un termometro e un manicotto
nella camera cilindrica attraverso due bocchettoni.
- Inserire il manicotto nella tavoletta di supporto di destra del manometro.
- Misurare la temperatura all’interno della camera cilindrica.
- Controllare che i livelli dell’acqua nel manometro siano uguali (per il principio
dei vasi comunicanti) e posti a livello zero.
- Riscaldare il recipiente cosicché si riscaldi anche l’aria all’interno della
camera cilindrica.
- Si noterà poi che man mano che la temperatura aumenta la colonna d’acqua nel tubo
di sinistra aumenterà. L’aumento dell’acqua nel tubo è uguale
all’accrescimento della pressione dell’aria.
- Dopo ogni misurazione bisogna portare il livello dell’acqua nel tubo di sinistra
allo zero.
- Costruire una tabella per le misurazioni.
- Effettuare in un sistema di riferimento cartesiano un grafico che collega volume e
temperatura.
- Osservare ciò che succede e concludere.
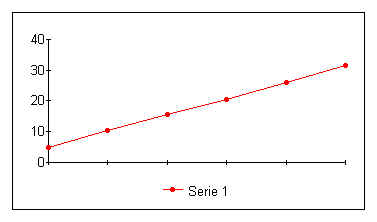
TABELLA

GRAFICO
CONCLUSIONI
La variazione di pressione in un gas perfetto a Volume costante è direttamente
proporzionale alla variazione di temperatura: P/T = K
ossia
P =P° (1+ADT) dove A è il coefficiente di dilatazione volumetrico dei gas
perfetti. |


